Souvent, le prix oriente davantage la décision que les caractéristiques techniques des produits. Une distinction essentielle, pourtant peu connue, réside dans les différences entre acides organiques et acides minéraux. Voici ce qu’il faut savoir.
Acide minéral ou organique : qu'est-ce que c'est ?
Un acide est une molécule AH qui, une fois mise en solution, libère des ions H+ en quantité variable selon sa nature. Ces ions H+ se lient aux molécules d’eau pour former des ions H₃O+, dont la concentration définit le pH de la solution
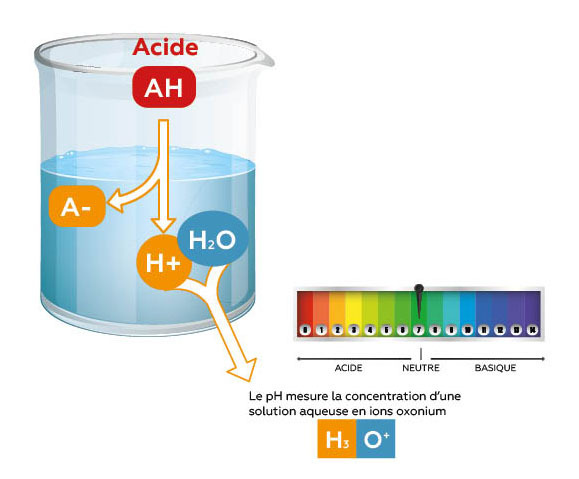
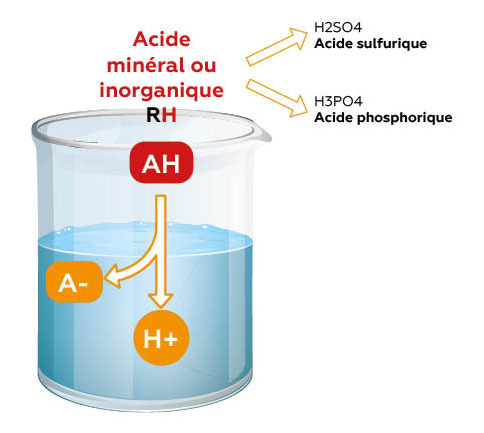
- Acides minéraux (ex : acide phosphorique, acide sulfurique) :
Ce sont des acides forts, c’est-à-dire qu’ils se dissocient totalement en solution. Autrement dit, la totalité des molécules d’acide libère leurs ions H+
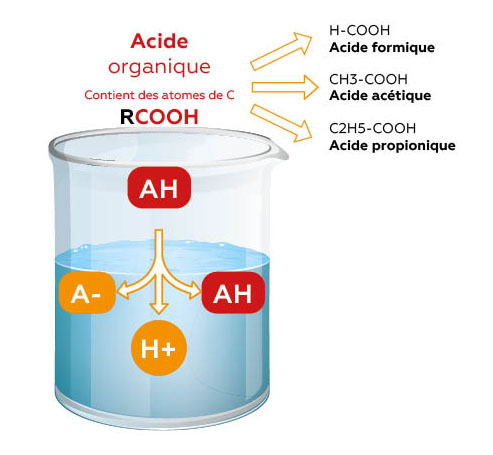
- Acides organiques (ex : acide formique, acétique, propionique) :
Ce sont des acides faibles, dont une partie reste sous forme « associée » (non dissociée) en solution.
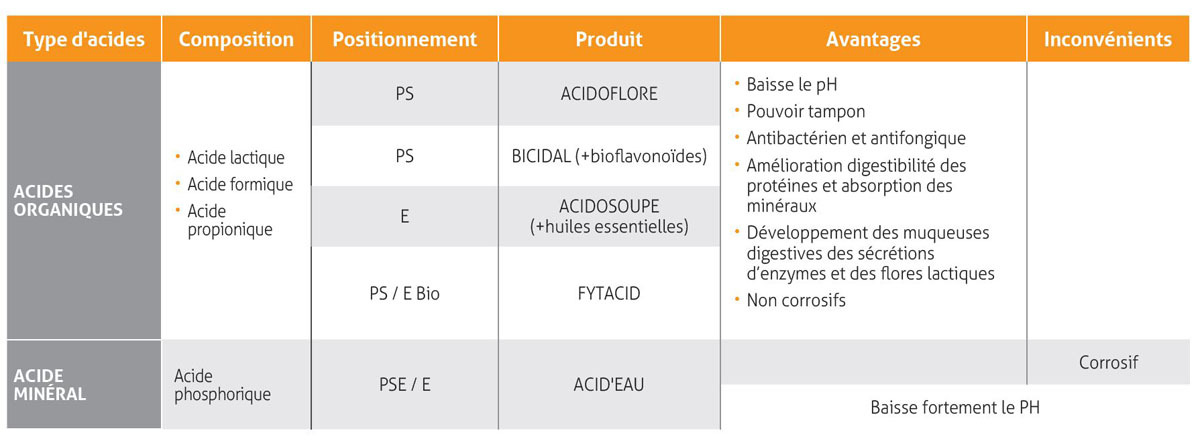
Avantages et inconvénients des différents acides
Impact des acides sur le pH
L’évolution du pH varie selon le type d’acide utilisé et la quantité ajoutée :
- Pour de faibles doses (100 ml/m³), le pH obtenu est similaire entre un complexe d’acides organiques (comme ACIDOFLORE®) et un acide minéral comme l’acide phosphorique.
- Cependant, à des doses plus élevées, les acides minéraux continuent de faire chuter le pH. Si la pompe doseuse fonctionne mal, cela peut entraîner un pH inférieur à 4, dangereux pour les muqueuses digestives des porcs.
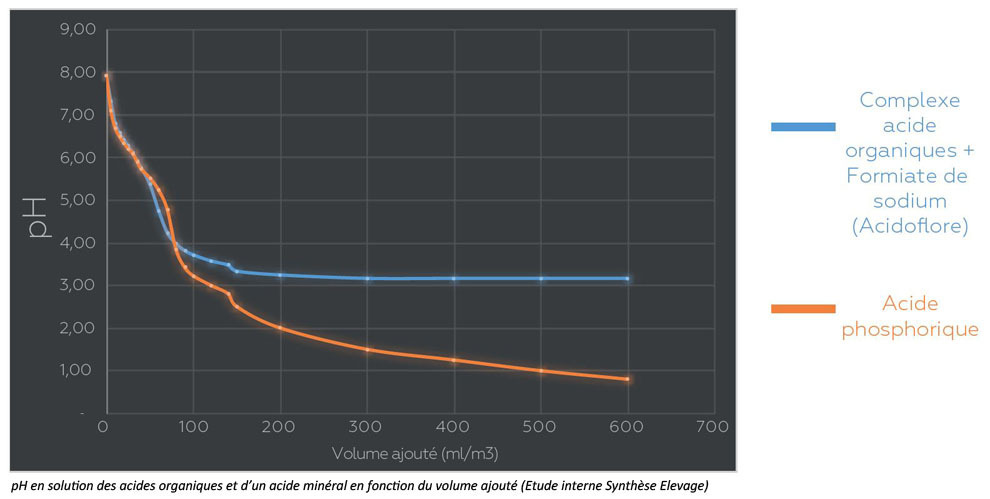
Les complexes d’acides organiques, en revanche, contiennent souvent des substances tampon (ex : formiate de sodium ou d’ammonium), qui limitent la baisse excessive du pH et sécurisent leur usage.

