Un acide est une molécule qui, mise dans l’eau, libère totalement ou partiellement ses ions H+. Le pH est la mesure du taux d’ions H+ libérés : plus ce taux est élevé, plus le pH baisse.
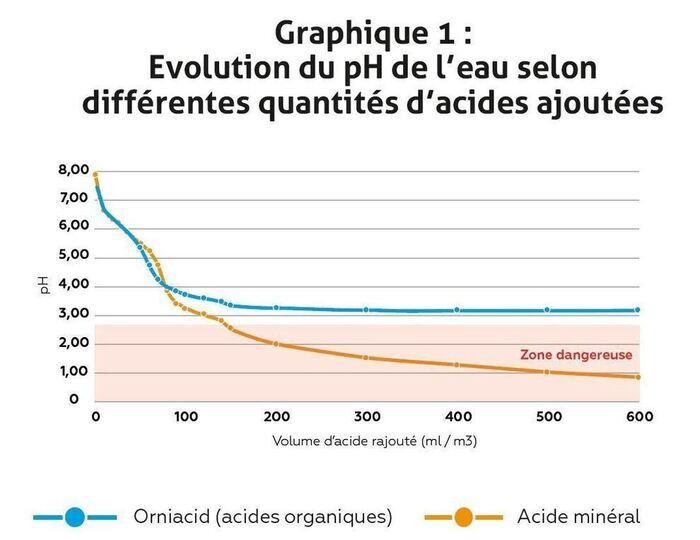
Des pH dangereux pour la santé des volailles, en dessous de 3, peuvent être observés avec l’administration des acides minéraux. Ils sont donc à utiliser avec une grande prudence.
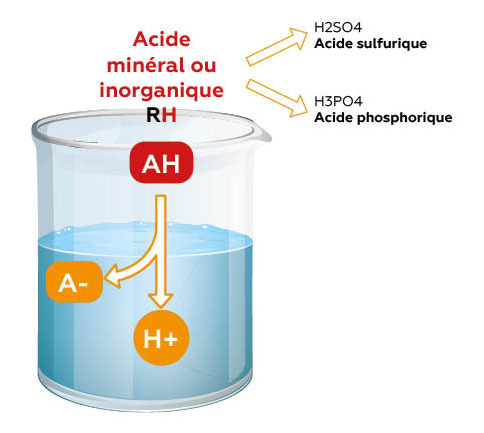
Acides minéraux
Acide sulfurique / Acide phosphorique
Une fois mis dans l’eau, la totalité des ions H+ est libérée.
• Baisse très forte, parfois dangereuse, du pH
• Perd son effet anti-bactérien
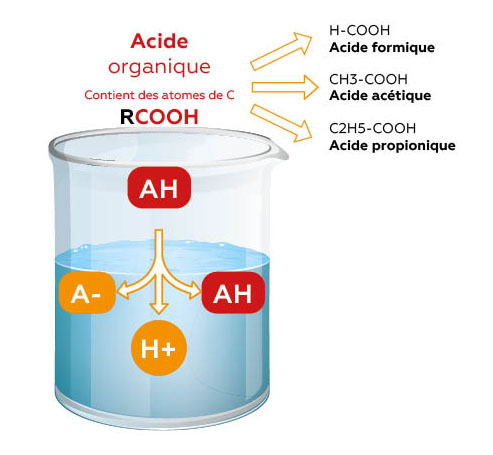
Acides organiques
Acide lactique / Acide formique / Acide propionique
Une fois mis dans l’eau, une partie seulement de l'acide perd son ion H+.
• Baisse du pH
• La fraction entière (forme associée) conserve son pouvoir antibactérien
Impact sur la baisse du pH
Dès que l’acide se sépare de son ion H+ (forme dissociée), il n’est plus capable de tuer les bactéries. Ces éléments vont nous permettre de comparer les acides forts (minéraux) et les acides faibles (organiques, contenant des atomes de carbone).
Afin d’améliorer la sécurité d’utilisation et l’efficacité des molécules, certains mélanges d’acides organiques performants, comme ORNIACID®, contiennent des molécules tampons qui limitent la libération des ions H+. Ainsi, le pH de la solution ne descend pas sous un certain seuil et n’atteint jamais la limite dangereuse pour les animaux (graphique 1). Par ailleurs, une quantité toujours suffisante de forme associée des molécules acides permet de garantir l’effet antibactérien.
Des pH dangereux pour la santé des volailles, en dessous de 3, peuvent être observés avec l’administration des acides minéraux. Ils sont donc à utiliser avec une grande prudence.